"CRISPR-Cas-stelsels" in bakterieë en virusse identifiseer en vernietig indringer virale volgordes. Dit is bakteriële en argaeale immuunstelsel vir beskerming teen virusinfeksies. In 2012 is CRISPR-Cas-stelsel erken as 'n genoom redigeer hulpmiddel. Sedertdien is 'n wye reeks CRISPR-Cas-stelsels ontwikkel en het toepassings gevind in gebiede soos in geenterapie, diagnostiek, navorsing en gewasverbetering. Tans beskikbare CRISPR-Cas-stelsels het egter beperkte kliniese gebruik as gevolg van gereelde voorkoms van buite-teiken redigering, onverwagte DNA-mutasies en oorerflike probleme. Navorsers het onlangs 'n nuwe CRISPR-Cas-stelsel aangemeld wat mRNA en mRNA kan teiken en vernietig proteïene geassosieer met verskillende genetiese siektes meer akkuraat sonder buite-teiken impak en oorerflike probleme. Met die naam Craspase, is dit die eerste CRISPR-Cas-stelsel wat wys proteïen redigering funksie. Dit is ook die eerste stelsel wat beide RNA en proteïen. Omdat Craspase baie beperkings van bestaande CRISPR-Cas-stelsels oorkom, het dit potensiaal om geenterapie, diagnostiek en monitering, biomediese navorsing en gewasverbetering te verander.
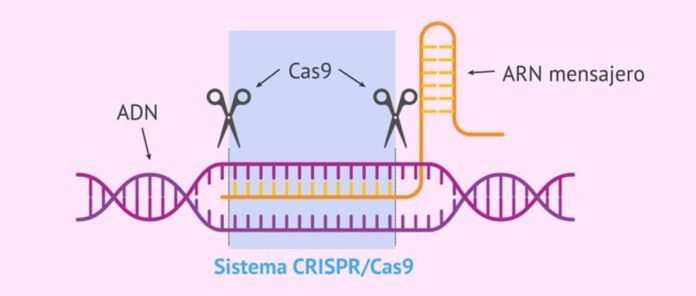
“CRISPR-Cas-stelsel” is die natuurlike immuunstelsel van bakterieë en archaea teen virale infeksies wat die volgordes in die virale geen identifiseer, bind en afbreek om te beskerm. Dit bestaan uit twee dele - bakteriële RNA getranskribeer vanaf die virale geen wat in die bakteriële genoom geïnkorporeer is na eerste infeksie (genoem CRISPR, dit identifiseer die teikenvolgordes van die indringer virale gene) en 'n geassosieerde vernietiger proteïen genoem "CRISPR geassosieer proteïen (Cas)” wat die geïdentifiseerde volgordes in die virale geen bind en afbreek om die bakterieë teen virusse te beskerm.
KNAPPER staan vir "clustered regularly interspaced short palindromic repeats". Dit is getranskribeerde bakteriële RNA wat gekenmerk word deur palindromiese herhalings.
Palindromiese herhalings (CRISPRs) is die eerste keer ontdek in die rye van E. coli in 1987. In 1995 het Francisco Mojica soortgelyke strukture in archaea waargeneem, en dit was hy wat die eerste keer daaraan gedink het as 'n deel van die immuunstelsel van bakterieë en archaea. In 2008 is dit vir die eerste keer eksperimenteel gedemonstreer dat die teiken van die immuunstelsel van bakterieë en archaea vreemde DNA was en nie mRNA nie. Die meganisme van identifikasie en degradasie virale volgordes het voorgestel dat sulke stelsels gebruik kan word as 'n hulpmiddel vir genoom redigering. Sedert sy erkenning as 'n genoom-redigeringsinstrument in 2012, het CRISPR-Cas-stelsel 'n baie lang pad gestap as 'n stewig gevestigde standaard gene redigering stelsel en het 'n wye reeks toepassings gevind in biogeneeskunde, landbou, farmaseutiese nywerhede, insluitend in kliniese geenterapie1,2.
'N Wye verskeidenheid van CRISPR-Cas-stelsels is reeds geïdentifiseer en tans beskikbaar vir die monitering en redigering van DNS/RNA-volgordes vir navorsing, dwelmsifting, diagnostiek en behandelings. Die huidige CRISPR/Cas-stelsels word in 2 klasse (Klas 1 en 2) en ses tipes (Tipe I tot XI) verdeel. Klas 1-stelsels het verskeie Cas proteïene wat 'n funksionele kompleks moet vorm om hul teikens te bind en op te tree. Aan die ander kant het Klas 2-stelsels net een groot Cas proteïen vir binding en afbrekende teikenreekse wat Klas 2-stelsels makliker maak om te gebruik. Algemeen gebruikte Klas 2-stelsels is Cas 9 Tipe II, Cas13 Tipe VI en Cas12 Tipe V. Hierdie stelsels kan ongewenste kollaterale effekte hê, dws buite-teiken impak en sitotoksisiteit3,5.
Geenterapieë gebaseer op huidige CRISPR-Cas-stelsels het beperkte kliniese gebruik as gevolg van gereelde voorkoms van buite-teiken redigering, onverwagte DNA-mutasies, insluitend groot DNA-fragment delesies en groot DNA strukturele variante op beide op-teiken en buite-teiken terreine wat lei tot selderftes en ander oorerflike probleme.
Craspase (of CRISPR-geleide caspase)
Navorsers het onlangs 'n nuwe CRISPER-Cas-stelsel gerapporteer wat 'n Klas 2 Tipe III-E Cas7-11-stelsel is wat met 'n kaspase-agtige geassosieer word. proteïen vandaar genoem Craspase of CRISPR-geleide kaspase 5 (Caspases is sisteïenproteases wat 'n sleutelrol speel in apoptose in die afbreek van sellulêre strukture). Dit het potensiële toepassings in gebiede soos geenterapie en diagnostiek. Craspase is RNA-geleide en RNA-gerig en raak nie betrokke by die DNA-volgordes nie. Dit kan mRNA teiken en vernietig en proteïene geassosieer met verskillende genetiese siektes meer akkuraat sonder impak buite die teiken. Dus, eliminasie van gene wat met siektes geassosieer word, is moontlik deur splitsing op mRNA- of proteïenvlak. Ook, wanneer gekoppel aan spesifieke ensiem, kan Craspase ook gebruik word om funksies van proteïene te verander. Wanneer sy RNase en protease funksies verwyder word, word Craspase gedeaktiveer (dCraspase). Dit het geen snyfunksie nie, maar bind met RNA en proteïenvolgordes. Daarom kan dCraspase gebruik word in diagnostiek en beelding om siektes of virusse te monitor en te diagnoseer.
Craspase is die eerste CRISPR-Cas-stelsel wat proteïenredigeerfunksie toon. Dit is ook die eerste stelsel wat beide RNA en proteïen kan redigeer. Sy gene redigering funksie kom teen minimale buite-teiken-effekte en geen oorerflike probleme nie. Craspase is dus waarskynlik veiliger in kliniese gebruik en terapeutiese middels as ander tans beskikbare CRISPR-Cas-stelsels 4,5.
Omdat Craspase baie beperkings van bestaande CRISPR-Cas-stelsels oorkom, het dit potensiaal om geenterapie, diagnostiek en monitering, biomediese navorsing en gewasverbetering te verander. Meer navorsing is nodig om betroubare afleweringstelsel te ontwikkel om siekteveroorsakende gene in die selle presies te teiken voordat veiligheid en doeltreffendheid in kliniese proewe bewys word.
***
Verwysings:
- Gostimskaya, I. CRISPR-Cas9: 'n Geskiedenis van die ontdekking daarvan en etiese oorwegings van die gebruik daarvan in genoomredigering. Biochemistry Moscow 87, 777–788 (2022). https://doi.org/10.1134/S0006297922080090
- Chao Li et al 2022. Rekenaargereedskap en hulpbronne vir CRISPR/Cas-genoomredigering. Genomika, Proteomika en Bioinformatika. Aanlyn beskikbaar 24 Maart 2022. DOI: https://doi.org/10.1016/j.gpb.2022.02.006
- van Beljouw, SPB, Sanders, J., Rodríguez-Molina, A. et al. RNA-gerigte CRISPR-Cas-stelsels. Nat Rev Microbiol 21, 21–34 (2023). https://doi.org/10.1038/s41579-022-00793-y
- Chunyi Hu et al 2022. Craspase is 'n CRISPR RNA-geleide, RNA-geaktiveerde protease. Wetenskap. 25 Aug 2022. Vol 377, Uitgawe 6612. pp. 1278-1285. DOI: https://doi.org/10.1126/science.add5064
- Huo, G., Shepherd, J. & Pan, X. Craspase: 'n Nuwe CRISPR/Cas-dubbelgene-redakteur. Functional & Integrative Genomics 23, 98 (2023). Gepubliseer: 23 Maart 2023. DOI: https://doi.org/10.1007/s10142-023-01024-0
***